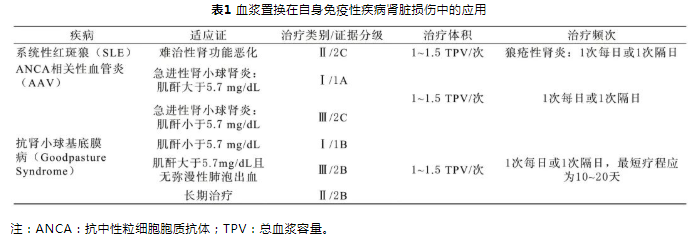
自身免疫性疾病是自身免疫介导、遗传因素和环境因素相互作用所致的一种免疫功能紊乱状态,机体正常的保护性应答不能区分自身抗原和外源性抗原转而攻击人体正常细胞和组织,引起脏器受损,从而出现的一系列异常症状[1]。研究表明有潜在的基因背景以及基因-环境的相互作用是决定自身免疫性疾病发病的关键[2]。此外自身免疫性疾病一旦造成肾脏受损,如果不及时治疗,极易发展为终末期肾脏疾病,复发率及病死率极高[3]。近年来随着血浆置换技术的发展及成熟,血浆置换联合其他综合治疗可迅速改善自身免疫性疾病患者的危重病情,明显缩短病程。本文基于最新的美国血浆置换学会(the american society for apheresis,ASFA)发布的《治疗性单采临床实践应用指南(第8版)》(https://onlinelibrary.wiley.com/
journal/10981101)及相关解读,结合最新的血浆置换治疗自身免疫性疾病相关研究报道,选择性总结了血浆置换在最容易引起肾脏受损的自身免疫性疾病(系统性红斑狼疮、抗中性粒细胞胞质抗体相关性血管炎、抗肾小球基底膜病)中的治疗作用,为今后临床医生在遇到自身免疫性疾病引起肾脏损伤的治疗提供更多参考(见表1)。
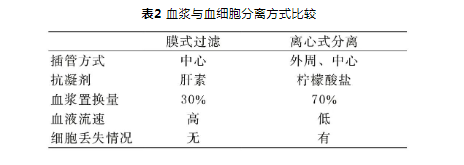
1 血浆置换简介 血浆中存在各种分子量不等的致病因子,对自身免疫性疾病的发生发展起重要作用,早在1914年,血浆置换(plasma exchange,PE)就首次在动物实验中描述并在1952年用于人体试验,随后PE逐渐被用于各种肾脏疾病的治疗[4]。PE可以将血浆连同溶于其中的自身抗体、免疫复合物、毒素等大分子物质通过离心或者过滤的方式进行清除,以减轻此类物质对机体的伤害,避免脏器受损,从而可以治疗一般疗法无效的多种自身免疫性疾病,达到暂时减轻和治疗疾病的目的[5]。血浆置换首先是将患者体内的血浆从血液循环系统中分离出来,分离方式包括离心式和膜式(见表2),然后将分离出来的血浆中的有害成分去除,目前主要包括以下三种方式:(1)治疗性血浆置换术(therapeutic plasma exchange,TPE):患者血液经过血浆分离器将血浆与细胞成分进行分离,非选择性地除去所有血浆成分并弃用血浆,然后使用新鲜血浆、白蛋白等胶体置换液进行补充。(2)双重滤过血浆置换术(double filtration plasmapheresis,DFPP):是继TPE之后发展起来的另一种血浆置换方式,其中DFPP有一个额外的二级过滤器,可选择性清除高分子量的血浆组分,如抗体和免疫复合物,并允许低分子量的血浆组分,如白蛋白,通过过滤器并回输到患者体内。(3)免疫吸附(immunoadsorption,IA):患者血液经血浆分离器分离出血浆后,经过高度特异性的抗原、抗体或有特定物理化学亲和力的物质(配体)与吸附材料(载体)结合制成的吸附剂(柱),可吸附血浆中的不同抗体与补体分子,选择性(特异性)更高,不需要置换液[8]。针对不同的疾病,可以选择不同的治疗方式,如TPE是完全弃用血浆,对血栓性血小板减少性紫癜(TTP)这类疾病的治疗最为合适。
此外PE对于有以下特点的自身免疫性疾病的治疗具有明显的优势:(1)致病物质分子量较大(> 30 KD),且不能用传统的血液净化方式(血液透析、血液滤过和血液灌流等)去除;(2)致病物质在体内半衰期较长,或者用于原发病治疗的药物起效较慢,体外清除可提供较长时间的低血浆浓度,可以为其他关键性治疗创造条件;(3)需清除的物质致病性很强或对常规疗法抵抗,短期内清除这些致病物质可以有效逆转疾病病程,降低病死率[6]。下文就PE对自身免疫性疾病肾脏损伤的修复作用进行回顾。
LEWIS等[8]比较了标准治疗及在标准治疗的基础上增加TPE治疗在SLE合并重症狼疮性肾炎患者中的肾脏修复效果,结果表明:如果以肌酐小于1.2 mg/dL和24小时尿蛋白排泄小于0.2 g/d为肾脏疾病缓解标准的话,TPE组有30%的患者肾脏疾病得到缓解,标准治疗组有28%的患者得到缓解(P=0.86)。在后期的随访中(平均随访136周)发现标准治疗组有17%患者发生终末期肾病,TPE组有25%患者发生终末期肾病(P=0.39),此项多中心的随机对照试验表明在标准治疗的基础上增加TPE治疗不能明显改善重症狼疮性肾炎患者的肾脏损伤。KRONBICHLER等[9]采用荟萃分析,纳入15篇文献,研究了TPE联合传统治疗在难治性肾功能恶化患者的治疗效果,结果表明TPE可以有效降低患者的血清肌酐水平及尿蛋白水平,初始肌酐从(2.27±1.25)mg/dL降至(1.84±1.62)mg/dL,尿蛋白从6.06 g/d降至(2.75±3.7)g/d,有效改善患者的肾功能。以上两篇报道对TPE在肾脏修复中的疗效之所以存在出入,究其原因可能有两点,一是LEWIS等研究报道较早,相关的TPE技术不是很完善成熟,二是LEWIS等入组的患者为重症狼疮性肾炎患者,可能已经错失TPE治疗的最佳时机。此外,许多国家对于难治性狼疮性肾炎,免疫吸附治疗(IA)已经取代TPE,因为IA去除疾病特异性抗体的速度超过TPE并且IA可以减少一些潜在的副作用,比如出血、过敏以及危及生命的严重感染[10]。对于难治愈性或者常规治疗禁忌证的SLE患者,STUMMVOLL等[11]采用高亲和力吸附柱的IA疗法可以使特异性抗体和免疫球蛋白水平降低75%,尿蛋白从(4.3±2.4)g/d降低到(0.5±0.4)g/d(P=0.02),肌酐清除率显著增加,血清肌酐水平降低,显著改善肾功能。对弥漫增生性狼疮性肾炎患者进行队列研究发现[12],在甲强龙治疗的基础上增加DFPP可以使患者尿蛋白及血清肌酐水平降低更快,有效缓解肾脏损伤,有助于弥漫增殖性狼疮性肾炎患者的病情缓解,并能有效预防疾病复发。
目前PE对SLE合并狼疮性肾炎的治疗效果已得到肯定,当类固醇或其他免疫抑制疗法无效并出现肾脏受累的情况时,及早进行PE治疗是一种安全有效的选择,此外,PE可以单独使用或与类固醇、免疫球蛋白或其他免疫抑制剂联合使用,可快速控制病情进展,有效清除体内自身抗体及免疫复合物,降低血清肌酐水平及尿蛋白水平,有效改善患者的肾脏损伤[13]。
SZPIRT等[15]在韦格纳肉芽肿血管炎的研究中发现,TPE可以改善患者在术后1,3,5个月及5年的肾功能,特别是对于肌酐水平高于2.85 mg/dL的患者,TPE与患者肾功能的改善情况显著相关,且不会增加患者的复发率和病死率。GONG等[16]研究发现DFPP可以有效清除AAV患者血清球蛋白、抗髓过氧化物酶(MPO)抗体,降低血清中ANCA的滴度,改善患者的肾损伤。YAMADA等[14]系统性地评估了TPE或者DFPP治疗对MPA、GPA等在内的AAV患者的疗效,发现早期行TPE或者DFPP可以降低肾脏损伤及终末期肾病的发生率,且不会增加感染和死亡的风险。
但近年来,关于TPE对AAV患者肾脏修复的治疗效果也存在一定的争议[17],一项以死亡或终末期肾病为研究终点的报道发现,对于重症AAV患者,TPE并没有降低死亡或终末期肾病的发生率,对于AAV患者在标准治疗的基础上行TPE对肾脏功能的恢复并无显著益处。WALSH[18]等也评估了TPE以及低剂量糖皮质激素在治疗严重AAV患者的效果,该项2×2析因设计的随机试验中,共招募了来自16个国家95个中心的704名新发或复发的严重AAV患者。研究者独立分析了TPE及两种不同剂量口服糖皮质激素的疗效。结果显示,TPE组的352例患者中的100例 (28.4%) 发生死亡或终末期肾脏疾病,而未接受TPE的352例患者中有109例 (31.0%) 发生死亡或终末期肾脏疾病,两组之间无显著性差异,表明TPE治疗对AAV患者的肾脏损伤修复无明显收益,相关研究发表在New England Journal of Medicine上。
尽管PE可以通过快速去除ANCA来减少器官损伤,在短期内可以改善AAV患者肾脏损伤,目前已被广泛用于AAV患者的治疗,但最近也有高质量的RCT试验表明,在标准治疗方案中加入PE对于重症AAV患者的肾脏损伤修复并未获益[19],因此PE对重症AAV患者的肾脏修复及长期的治疗作用可能仍然需要进一步的研究来证实。但对于AAV患者来说,未经治疗自然病死率极高,而大量使用糖皮质激素等免疫治疗势必也会增加相关的不良反应,因此在免疫抑制治疗的基础上联合PE治疗或许是目前最好的选择,但二者的平衡也须慎重考虑。
CUI等[21]研究发现TPE联合糖皮质激素和环磷酰胺治疗抗GBM病,可以迅速清除抗GBM抗体,可以使患者的平均血清肌酐浓度水平显著下降,特别是对有严重肾损害(血清肌酐超过6.8 mg/dL)的肾脏修复效果明显,此外早诊断早治疗也是改善患者肾脏功能的关键。BIESENBACH等[22]研究了IA在GBM病患者中的治疗效果,结果显示IA平均治疗9次后抗GBM抗体下降到正常水平,对于肾脏修复来说,诊断时肾脏存活率为40%,IA治疗结束时肾脏存活率为70%,一年后肾脏存活率为63%,随访结束时为50%(平均84个月),IA无论是对抗GBM抗体的清除率还是对肾脏损伤的修复效果均不亚于TPE。此外也有相关研究比较了DFPP和IA在抗GBM病治疗中的疗效[23],发现两者都能明显清除抗GBM抗体,患者的总体存活率及肾脏存活率也是类似的,但DFPP对于血清肌酐水平大于5.66 mg/dL且有严重慢性肾病患者,特别是病程较长的患者,可能会减少并发症的发生。当患者有严重的Goodpasture综合征或者肾功能严重衰竭时,PE可以快速清除循环抗GBM抗体,可以增加患者肾脏功能恢复的机会,提高患者生存率[24]。
PE可以有效清除抗GBM患者体内自身抗体、改善预后,增加对免疫抑制的敏感性,改变T细胞亚群活性变化[25]。目前相关指南指出,在对抗GBM病患者行PE时,PE治疗应持续至少14天或直到自身抗体检测不到,PE联合免疫抑制治疗2周后大多数患者的抗体会转阴,最短疗程一般为10~20天,如果后续患者抗体反弹,应恢复PE,如果患者有出血风险,建议更换新鲜冰冻血浆,此外抗体的存在与否不应作为启动或终止PE的指征,而肾损伤得到修复可以作为停止PE的指标[6]。
自身免疫性疾病一旦累及肾脏,可导致小血管炎症和硬化,影响肾脏滤过功能,可导致血尿和蛋白尿,严重的会造成肾功能衰竭。当自身免疫性疾病患者肾脏受损在常规激素及免疫抑制剂治疗效果不理想,有可能出现重要肾脏功能不全或合并严重并发症,或病情进展迅速时,尽早进行PE治疗,通过调节机体免疫状态,有利于自身免疫性疾病肾脏损伤的治疗。此外在进行PE治疗时,要充分考虑置换液的成分和容量,在成分上,需要考虑补充丢失的白蛋白、电解质成分,确保血浆胶体渗透压和电解质平衡,同时也要考虑免疫球蛋白、凝血因子、纤维蛋白原的补充;在容量上,考虑等量置换原则,确保置换液输入与血浆滤出速度一致,维持血流动力学稳定,此外在行PE时要密切注意患者是否发生不良反应(如心律失常等),一旦发生须立即停止。